Vorlesung: Silicatchemie
7. Schicht(Phyllo)-Silicate
7.5 Natürliche Schichtsilicate
7.5.1 Übersicht, Allgemeines
Strukturprinzip
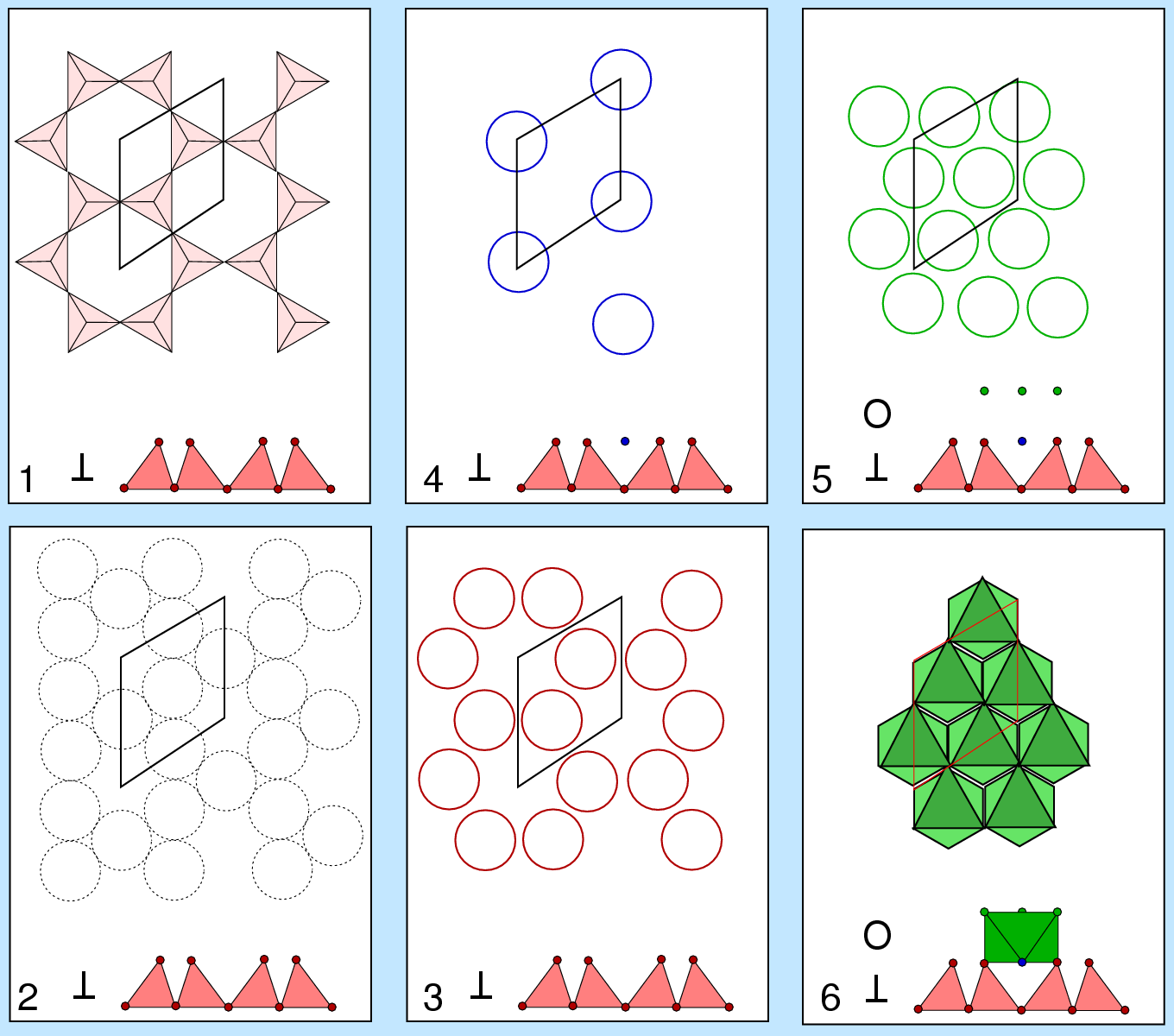
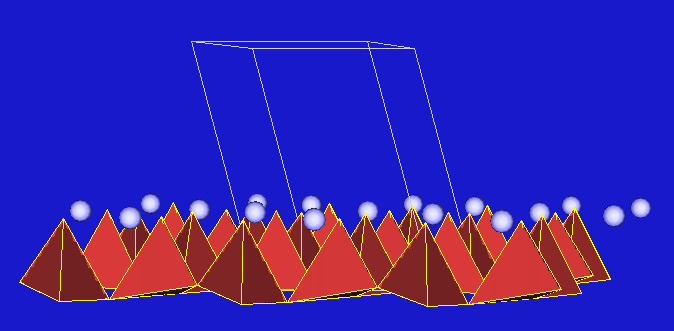
Gemeinsames Strukturelement fast aller natürlichen Schichtsilicate
sind ebene Silicatschichten, in denen die Tetraeder über drei der vier Ecken verknüpft sind.
Die Polyederdarstellung (Abb. 7.5.1. links bzw. rechts 1) zeigt, dass sich als Elementarzellinhalt
Si2O3O4/2 = [Si2O5]2- ergibt.
In der Kugeldarstellung (Abb. 7.5.1. rechts 2 und 3) sind die Sauerstoffatome der Tetraederbasisflächen
auf Kontakt dargestellt (gestrichelte Kugeln), die freien Tetraederspitzen
(zwei Stück pro Elementarzelle) sind als rote Kugeln gezeichnet
(Elementarzellinhalt Si2(Ounten,MitteO4/2unten,Kanten)
(O2Spitzen)2- = [Si2O3O2]2-). Die Tetraederspitzen alleine bilden
eine ebene 63-Schicht
mit großen sechseckigen Lücken. In den Schichtsilicaten sind - wie bei den Amphibolen
- weitere O- bzw. OH-Atome (blau) in diese Lücken eingebaut, so dass sie
gemeinsam mit den Tetraederspitzen (rot) eine dichte Kugelpackung in der Ebene (Orientierung A)
bilden. Die Formel (Elementarzellinhalt) erweitert sich damit auf
[Si2O3O2(OH)]3- = [Si2O5(OH)]3-.
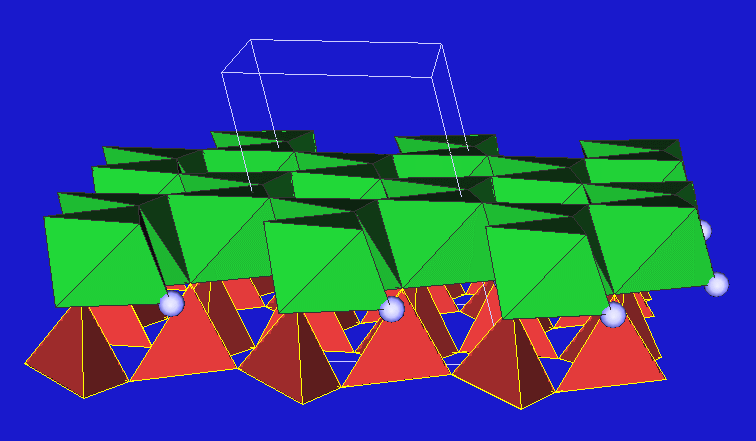
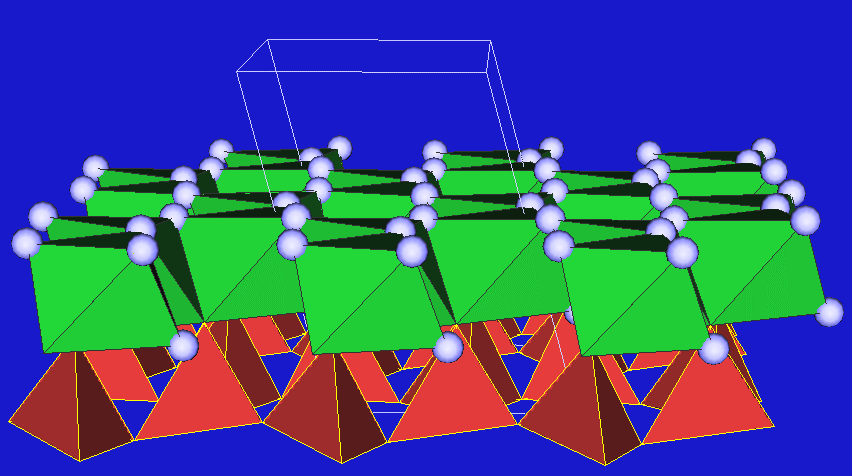
Auf diese dichte Packung folgt stets eine weitere O/OH-Schicht (grün, 5) der Orientierung B.
Zwischen den beiden dichten Schichten liegen insgesamt drei
Oktaederlücken/EZ, so dass die Zusammensetzung [Si2O5(OH)](O/OH)3 folgt.
Je nachdem, ob die Schicht B nur aus OH--Ionen oder aus einer umgekehrt
angeordneten zweiten Silicattetraeder/OH-Schicht besteht unterscheidet man weiter:
- Kationenreiche Schichtsilicate (Zweischichtsilicate mit
Tetraeder-Oktaeder(T-O)-Anordnung). In diesen Fällen besteht die
dichte Schicht der Orientierung B nur aus OH--Ionen, die Formel/EZ
lautet [Si2O5(OH)(OH)3]6-
- Kationenarme Schichtsilicate (Dreischichtsilicate mit
Tetraeder-Oktaeder-Tetraeder (T-O-T) Anordnung).
Hier ist eine zweite identische Silicat/OH-Schicht umgekehrt so über der
ersten angeordnet, dass die beiden O/OH-Schichten mit der Orientierung A-B
übereinander zu liegen kommen.
Daraus ergibt sich eine Formel/EZ von [Si2O5(OH)3-]2
entsprechend [Si4O10(OH)2]6-.
In beiden Fällen liegen zwischen den dichten Schichten A-B drei oktaedrische Lücken, in denen
Kationen zum Ausgleich der Schichtladung von 6- (für T=Si) eingebaut werden.
Je nach der Zahl der Kationen unterscheidet man sowohl für kationenreiche als auch
für kationenarme Schichtsilicate jeweils zwei Gruppen:
- In den trioktaedrischen Schichtsilicaten sind alle (d.h. drei pro Formeleinheit)
Oktaeder mit Kationen gefüllt. Z.B. können drei Mg2+-Ionen die Schichtladung
ausgleichen, so dass die Zwischenschicht dem Brucit Mg(OH)2
(CdI2-Typ) entspricht.
- In dioktaedrischen Schichtsilicaten sind nur zwei der drei Oktaederlücken der Zwischenschicht
mit Kationen gefüllt. Z.B. reichen zwei Al3+-Ionen zum Ladungsausgleich und in diesem
Fall entspricht die an die Silicattetraederschicht(en) kondensierte Zwischenschicht
dem Hydrargillit Al(OH)3 (BiI3-Typ,
VRML einer Schicht).
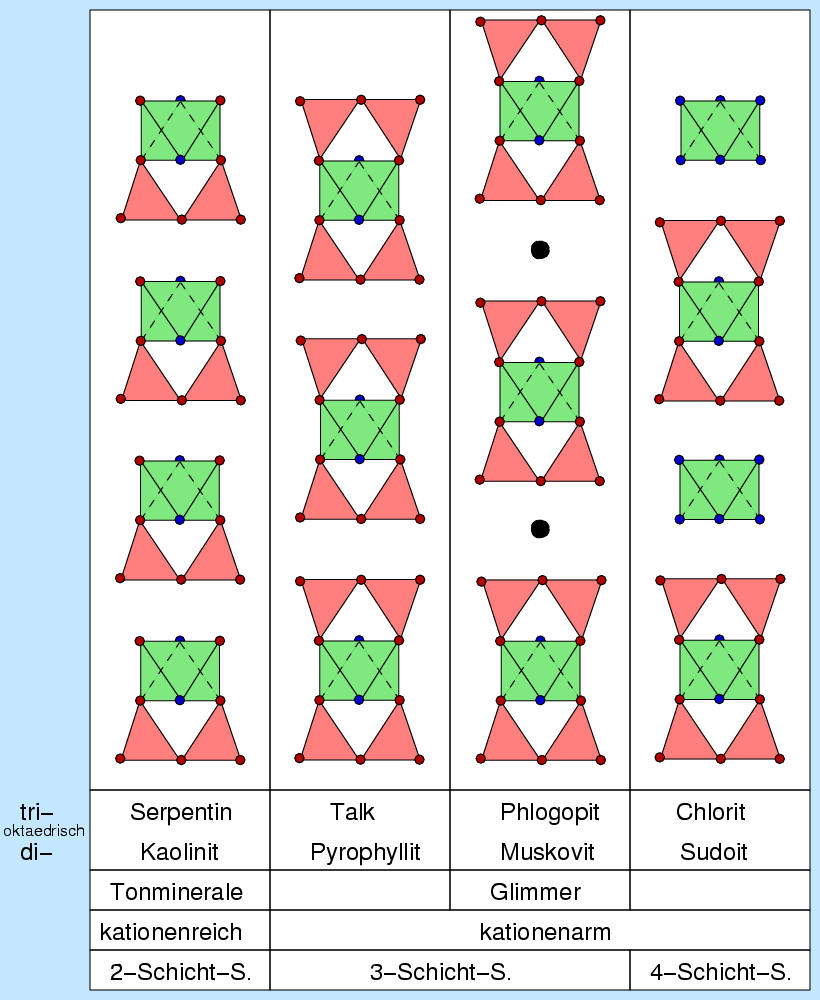
Die Bilder-Serien in Tabelle 7.5.1. zeigen je ein Beispiel
für ein dioktaedrisches Zweischichtsilicat (Kaolinit, oben) und
für ein trioktaedrisches Dreischichtsilicat (Talk, unten).
Tab. 7.5.1. Strukturen verschiedener nat�rlicher Schichtsilicate
Zusätzliche Variationen von Schichtsilicattypen entstehen durch
eingelagerte Kationen bei geladener Schicht (s. Kap. 7.5.4.) oder durch eingelagerte
Metall-Hydroxid-Schichten (s. Kap. 7.5.5.).
Die folgende Abbildung 7.5.2. gibt eine Übersicht über die wichtigsten Varianten:
 |
| Abb. 7.5.2. Strukturen verschiedener Schichtsilicate
‣SVG |
Die Mineralgruppen sind in tabellarischer Übersicht in Abb. 7.5.2. zusammengestellt
(Z=Zahl der Schichten)
| Z |
T |
nicht hydratisiert |
hydratisiert |
| dioktaedrisch |
trioktaedrisch |
dioktaedrisch |
trioktaedrisch |
| |
| 2 |
Si |
Kaolinit |
Serpentin |
Hydrohalloysit |
- |
| Al2[Si2O5(OH)4] |
Mg3[Si2O5(OH)4] |
Al2[Si2O5(OH)4] . (H2O)2 |
- |
| |
 |
|
|
| B+M |
B+M |
|
|
| Si/Al |
Donbassit |
Berthierine |
- |
- |
| |
| 3 |
Si |
Pyrophyllit |
Talk |
Montmorillonit |
Saponit |
| Al2[Si4O10(OH)2] |
Mg3[Si4O10(OH)2] |
Mg0.33Al1.67[Si4O10(OH)2] . (Ca,Na)x(H2O)n |
(Mg,Fe)3[Si4O10(OH)2] . (Ca,Na)x(H2O)n |
| (B+M) |
(B+M) |
L3 |
L4 |
| Si/Al |
Glimmer |
|
Vermiculite |
|
| Muskovit |
Biotit |
- |
- |
| KAl2[AlSi3O10(OH)2] |
K(Mg,Fe)3 [AlSi3O10(OH)2] |
(Mg,Al,Fe)2 [AlSi3O10(OH)2] . (Mg,Ca)x(H2O)n |
(Mg,Fe)3 [AlSi3O10(OH)2] . (Mg,Ca)x(H2O)n |
| |
|
 |
|
|
| L1 |
L2 |
L3 |
L4 |
| |
| 4 |
Si |
- |
- |
- |
- |
| Si/Al |
Sudoit |
Chlorit |
- |
- |
| Al2[AlSi3O10(OH)2] . A2.33(OH)6 |
Mg,Fe,Al)3[(Al/Si)4O10(OH)2] . (Mg,Fe)3(OH)6 |
- |
- |
| L1 |
L2 |
L3 |
L4 |
Tab. 7.5.2. Tabellarische �bersicht zu nat�rlichen Schichtsilicaten
mit Links zur Mineralogie (M) und Bildern (B)
In den folgenden Abschnitten werden die wichtigsten Schichtsilicate
besprochen: in Kap. 7.5.2. zunächst die neutralen
Zweischichtsilicate Kaolinit und Serpentin, im Abschnitt 7.5.3.
die neutralen Dreischichtsilicate Talk und Pyrophyllit.
Die Kapitel 7.5.4. und 7.5.5.
beschreiben die geladenen Alumosilicate vom Glimmer- bzw. Chlorit-Typ.
7.5.2. Serpentin, Kaolinit (Zweischichtsilicate)
Zweischichtsilicate weisen eine T-O-Stapelung ohne weitere Kationen zwischen den Schichten
auf (Ausnahme: Alumosilicate der Donbassit und Berthieringruppe).
Der Ladungsausgleich erfolgt durch die Kationen in den Oktaederlücken, so
dass; wie oben
unterschieden werden kann:
- Besetzung aller drei Lücken/Formeleinheit liegt in den trioktaedrische Mineralien vor.
Wichtigster Vertreter ist (mit Mg36+ zum Ladungsausgleich)
der Serpentin Mg3[Si2O5(OH)4]).
- Sind nur zwei der drei Okatederlücken besetzt, so liegen dioktaedrische Mineralien vor.
Im Kaolin gleichen zwei Al-Ionen (Al26+) die Schichtladung aus.
Entsprechend ergibt sich die Formel Al2[Si2O5(OH)4].
Obwohl Magnesium und Aluminium die wichtigsten Kationen in Zweischichtsilicaten sind, sind
auch Mineralien mit diversen anderen Kationen bekannt:
- Mg+Al: Amerit?
- Ni: Garnierit
- Co: Co-Crysotilasbest
- Fe: Cronstedtit
- Fe+Al: Chanoisit
Bei allen kationenreichen Schichtsilicaten bestehen Passfehler zwischen der Tetraeder- und der
Oktaederschicht, die Spannungen der Doppelschicht zur Folge haben. Bei großen Kationen
(z.B. Mg32+) ist die Oktaederschicht größer als die Tetraederschicht
(l1 > l2). Der umgekehrte Fall tritt bei kleinen Kationen
z.B. Al23+ auf: Hier ist l1 < l2, d.h. die
Tetraederschichten sind größer als die Oktaederschichten.
 |
| Abb. 7.5.3. Abbau
der Spannungen in T-O-Doppelschichten
‣SVG |
Der Ausgleich dieser Spannungen (s. Abb. 7.5.3.) wird erreicht durch:
- Einrollen: Z.B. treten im Halloysit (Al3+ in Oktaederlücken)
Röllchen auf, bei denen die [SiO4]-Tetraederschicht außen
liegt (B+M),
während im faserigen Serpentin (Chrysotil, s. Abb. 7.5.3. links sowie Fotos in Abb. 7.5.4.),
wo große Mg2+-Ionen die Oktaederpositionen einnehmen, die
OH--Schicht außen zu liegen kommt. Die Röllchen im Chrysotil-Asbest
haben einen Außendurchmesser von ca. 20 nm und einen
Innendurchmesser von ca. 5 nm. Die Fasern von
Chrysotilasbest (Weißasbest) sind sehr weich und gut verspinnbar, so
dass er früher vielfältig eingesetzt wurde. Im Unterschied zu den
Amphibolasbesten ist Weißasbest wegen der äußeren OH-Schicht nicht
säurestabil.
- Verzerren der Schichten entweder durch Modifzierung der [SiO4]-Tetraeder
oder durch die Verschiebung der Schichten gegeneinander.
- Anpassung der Oktaederschicht durch Kationen-Kombination, d.h. Ausgleich von
großen und kleinen Kationen.
- Tetraederumkehr nach einigen Einheiten. Diesen Fall findet man beim
blättriger Serpentin (Antigorit), wo alle 10-20 Zweiereinfachketten
die Tetraederausrichtung umkehrt (s. Abb. 7.5.3. rechts).
 |
 |
 |
| Abb. 7.5.4. Fotos von
aufgearbeitetem bzw. nat�rlichen Chrysotilasbest (Wei�asbest)
|
Die Stapelung der Schichten ist in den Zweischichtsilicaten nie ganz regelmäßig, so
dass auch verschieden reaktionsfähige Kaolinite folgen.
Bei der Stapelung wird eine maximale H-Brücken-Ausbildung angestrebt.
Als Fehlordnung kommen sowohl Translationsfehlordnungen
(Schichten gegeneinander verschoben) als auch Substitutionsfehlordnungen
(z.B. Variation des Al-Mg-Verhältnisses) vor.
Zu den beiden wichtigsten Vertretern:
- Serpentin Mg3[Si2O5(OH)4] kommt je nach der Art des Spannungsausgleichs
als faseriger Serpentin (Chrysotil) (B+M)
oder blättriger Serpentin (Antigorit)
(B+M) vor.
Die Faserform wurde früher in großem Umfang als Asbest eingesetzt.
- Kaolinit Al2[Si2O5(OH)4]
ist in der Natur sehr häufig, kann aber auch synthetisch aus Kieselsäure und Al(OH)3
hergestellt werden.
Er bildet sehr dünne, nur wenige 100 Angstroem dicke Blättchen, die
weiß und weich (plastisch) sind. Kaolinit ist durch Intercalation
quell- und schrumpfbar und weist gutes Bindevermögen auf.
Kaolinit bildet mit wenig Na2CO3-Lösung oder Wasserglas eine Flüssigkeit, die
Thixotropie zeigt.
Aufgrund der genannten Eigenschaften findet Kaolinit vielfache Anwendung:
- Bei Keramik und Töpferwaren wird einerseits die Eigenschaft
der Quellbarkeit ausgenutzt, die zu gut verarbeitbaren Massen
führt (Formgebung). Beim Brennen der Rohlinge bei 950-1000 oC entstehen
je nach Zusammensetzung und exakten Bedingungen
Andalusit, Sillimanit, Kyanit oder Mullit (verfilzte Nädelchen: Porzellan).
Für Porzellan werden Fe-freie Kaolinite eingesetzt, während für
Tonwaren der Eisengehalt je nach Brennbedingungen charakteristische Farben ergibt.
Rote und schwarze Farbtöne können mit derselben chemischen Zusammensetzung
erzeugt werden: bei oxidierenden Brennbedingungen (Alkaliarme Kaolinite)
entsteht die für Fe3+ charakteristische rötliche Farbe.
Schwarze Keramiken,
die Fe2+ neben Fe3+ enthalten (gemischtvalente
Verbindung wie z.B. Hammerschlag Fe3O4)
entstehen bei reduzierenden Brennbedingungen. Wenn viele
Alkalimetallkationen anwesend sind,
schmilzt die Keramik schneller und wird dadurch stärker reduziert.
- Kaolinit wird als Füllmaterial für Gummi, Kunststoffe und Lacke zur
Erhöhung der Abriebfestigkeit und der Deckkraft sowie zur Verbesserung der
Fließeigenschaften eingesetzt.
- Im Bauwesen kommt Kaolinit als Betonfüllstoff zum Einsatz.
- Kaolinit wird zur Papierbeschichtung (glatte Oberfläche) und als Füller eingesetzt,
wobei bis zu 40% Kaolin-Anteil im Papier möglich sind.
- Wegen der Adsorptionseinschaften wird Kaolinit zum Entfärben und Reinigen von Speiseölen verwendet.
- Als 'bolus alba' dient er der Darmentgiftung (statt Aktivkohle).
- Kaolinit ist ein wichtiges Ausgangsprodukt für die synthetische Herstellung von
Ultramarinen und diversen Molekularsieben (s. Kap.
8).
Kaolinit kann verschiedene Arten von Reaktionen eingehen, die an den drei Arten von
Oberflächen stattfinden:
- Verhalten am Rand: Oktaeder ist durch OH-Gruppen abgesättigt. Wegen der
Elektroneutralität ist noch ein H^+ in der Nähe \\
- Reaktionen an der Tetraederschicht: die Tetraederschicht hat ein hohes
Kationenaustauschvermögen, ist aber nicht quellbar.
an der begrenzenden Schicht kann Si4+ gegen Al3+ ersetzt werden
die SiO4-Schicht ist in Brenzcatechin löslich
- Reaktionen an der Oktaederschicht: wie die Tetraederschicht hat auch die
Oktaederschicht ein Anionenaustauschvermögen, jedoch bei
unterschiedlichen Konzentrationen: z.B. Kaolinit + NaF.
In jedem Fall treten aber deutlich zwei Mechanismen des Austauschs auf.
Das Austauschvermögen hängt vom Durchmesser der Kristallite und
nur von deren Dicke (seitliche Oberfläche) ab.
7.5.3. Talk, Pyrophyllit (Dreischichtsilicate)
Die reinen Dreischichtsilicate (kein Al auf den T-Plätzen)
enthalten neutrale T-O-T-Schichten ohne Kationen zwischen den Schichten.
Der Ladungsausgleich erfolgt durch die Kationen in der Oktaederschicht, so
dass wieder
die obengenannte Unterschiedung der Minerale möglich ist:
- In trioktaedrischen Mineralien sind alle drei Oktaederlücken besetzt,
der wichtigste Vertreter mit Mg36+ zum Ladungsausgleich ist der
Talk Mg3[Si4O10](OH)2.
- Bei Besetzung von zwei Lücken pro Formeleinheit (dioktaedrische Mineralien) ist
der Grundtyp wieder die Al-Verbindung (Al26+), der Pyrophyllit
Al2[Si4O10](OH)2.
Zu den beiden wichtigsten Vertretern:
- Im Talk Mg3(OH)2[Si4O10]
liegen neutrale Schichten vor, so dass zwischen ihnen nur schwache Anziehungskräfte
(van der Waals) wirken. Entsprechend ist Talk sehr weich (Mohs-Härte 1-2),
fühlt sich fettig an und zeigt gute Schichtenspaltbarkeit.
Jährlich werden mehrere Megatonnen Talk gewonnen, die als Puder, Schmiermittel,
Poliermittel, Füllmaterial für Papier, Schneiderkreide,
Speckstein (leicht bearbeitbarer Stein, Steinschnitzerei) und als Rohstoff für
Elektrokeramik Verwendung finden.
- Pyrophyllit Al2[Si4O10](OH)2
zeigt ähnliche Eigenschaften wie der Talk, wobei das Mineral häufig durch Fe-Anteile
grünlich gefärbt ist. Auch die Verwendung ist ähnlich wie bei Talk.
Pyrophyllit wird darüberhinaus als 'Futtermaterial' für Höchstdruckzellen bei der
Diamantsynthese eingesetzt.
Wenn zwar dioktaedrische Minerale vorliegen, bei denen sich aber Mg statt Al auf den Oktaederpositionen
befindet, entstehen die geladenen Schichten des hydratisierten Montmorillonits
(s. unten für unterschiedliche Prinzipien zur Erzeugung von Ladung der T-O-T-Schicht).
??? Rest-Links ???
| Talk |
M,
B
|
Phyrophyllit |
,
M,
B,
B
|
7.5.4. Glimmerartige Schichtsilicate (Dreischichtalumosilicate)
Die Glimmerartigen Schichtsilicate enthalten geladene Dreier-Schichten (T-O-T).
Je nach Ursache für die Schichtladung unterscheidet man die verschiedenen Ladungstypen:
- Erfolgt ausgehend vom Pyrophyllit Al2[Si4] die Modifizierung der
Oktaederschicht, so liegt der Montmorillonitische Ladungstyp vor (Austausch von
Aluminium gegen Magnesium auf den Oktaederplätzen).
- Wird die Tetraederschicht z.B. durch den Austausch von
Silicium gegen Aluminium modifiziert, so liegt der Beidellitische Ladungstyp vor.
Häufige Fälle für den Beidellitischen Ladungstyp sind:
- [(AlSi3O10)](OH)27- (Alkali-Glimmer)
- [(Al2Si2O10)](OH)28- (Sprödglimmer)
In beiden Fällen erfolgt der Ladungsausgleich durch (auch hydratisierte) Kationen zwischen den Schichten.
Häufig sind hier Na+, K+ und Ca2+, die von 12
Sauerstoffatomen koordiniert sind.
Die Ladung wird auch wieder durch die Kationen in der zentralen Oktaederschicht
des Dreifachschichtpacketes bestimmt. Nach den letzteren unterscheidet man wieder in:
- Dioktaedrische Mineralien (zwei Oktaederlücken besetzt) der Muskovit-Reihe.
(Muttertyp mit Al26+: Muskovit KAl2[AlSi3O10](OH)2
- Trioktaedrische Mineralien (alle drei Lücken besetzt) der Biotit-Reihe.
(Muttertyp mit Fe/Mg36+: Biotit K(Fe/Al)3[AlSi3O10](OH)2
Insgesamt sind zahlreiche Variationen geladener Dreischichtsilicate denkbar.
Ausgehend von der allgemeinen Formel:
(Al2-yMgy)[Si4-xAlxO20(OH)2](x+y)-
können Mineraliengruppen für unterschiedliche Werte von x und y (x+y: Schichtladung)
unterschieden werden (DO=dioktaedrisch, TO=trioktaedrisch):
| x+y |
Mineralfamilie |
| 0-0.25 |
Hektorite |
|
| 0.25-0.55 |
Smektite: (häufig: 0.33) |
Montmorillonite (DO, T=Si4) |
| Beidellite |
| 0.55-0.70 |
Vermiculite (TO, auch DO; häufig: 0.66) |
| 0.70-1.20 |
Glimmer allgemein (Muskovit DO, Biotit TO) |
| x+y=0.70-0.90 |
Illite |
| x+y=0.90-1.2 |
Serizite |
| 2 |
Sprödglimmer |
Margarit CaAl2[Al2Si2] |
| Xanthophyllit CaMg3[Al2Si2] |
Tab. 7.5.3. Glimmerartige Minerale (geladene Dreischichtsilicate)
DO: Dioktaedrische Minerale; TO: Trioktaedrische Minerale
Je höher die Schichtladung (x+y), umso härter sind die Minerale und
die Schichtenspaltbarkeit nimmt ab: Während die neutralen Hektorite (z.B.
Talk und Pyrophyllit ein Mohshärte von 1-2 aufweisen, steigt sie in den Glimmern
auf 2-3 und schließlich bei den Sprödglimmern mit einer Schichtladung von 2 auf
3.5 bis 5.
Silicate mit x+y zwischen 0.2 und 1.2 sind durch Hydratisierung der eingeschlossenen Kationen
quellbar. Unterhalb von 0.2 stehen zuwenige Kationen für die Quellung zur Verfügung.
Oberhalb x+y=1.2 ist die Schichtladung zu hoch für eine Quellung.
Vorkommen, Eigenschaften und Verwendung der wichtigsten glimmerartigen Mineralien
- Die Glimmer machen 3.5 % der Erdkruste aus.
Sie bilden spröde, dünne, steife Plättchen und Tafeln mit ausgeprägter
Schichtenspaltbarkeit. Die Kristallite sind transparent, elektrisch isolierend
und von guter thermischer und chemischer Widerstandsfähigkeit.
Glimmer finden als elektrische Isolationsmaterialien Verwendung.
- Montmorillonit ist das Hauptmineral des Bentonits und
wird als Füller für Gießereisand und (wegen der thixotropen Eigenschaften)
als Ölbohrlochschlamm verwendet.
- Vermiculit (trioktaedrisch, beidellitischer Ladungstyp) ist in in der Natur hydratisiert.
und wird in expandierter/geblähter Form (kurzzeitiges Erhitzen auf 1500oC, dabei 20-fache
Volumenvergrößerung) als Polymer- und Beton-Füller zur Wärme- und Schallisolation sowie
als Verpackungsmaterial (da auch flüssigkeitssaugend) eingesetzt.
 |
 |
 |
| Abb. 7.5.5. Fotos von
Glimmern (links: Lepidolith, rechts: Muskovit)
|
Links zur Mineralogie (M) und Bilder (B) von Glimmern
| Glimmer (Übersichten) |
M,
B+M
|
Biotit |
B+M,
B,
B,
B,
M
|
| Lepidolith (Li-Glimmer) |
B+M,
B,
B,
B
|
Phlogopit |
B,
B+M
|
| Montmorillonit |
B+M,
M,
B
|
Muskovit |
B+M,
M,
B
M,
B,
B
|
| Fuchsit (Cr-Muskovit) |
B+M,
B,
B
|
Smectit |
B+M
|
| Vermiculit |
B+M
|
Illit |
B+M
|
| Margarit |
B+M
|
7.5.5. Chlorit (Vierschichtalumosilicate)
Vierschichtsilicate enthalten zwischen den T-O-T-Dreifachschichten zusätzlich
Brucit- (trioktaedrisch) bzw. Hydrargillit- (dioktaedrisch) Schichten. Reine
Silicate sind unbekannt, es sind nur
Vierschichtalumosilicate mit geladenen Dreischichtalumosilicate (T-O-T) bekannt.
Je nachdem, ob als vierte Schicht Al(OH)3 oder Mg(OH)2 eingelagert
ist, unterscheidet man:
- Bei Besetzung von zwei Lücken/Formeleinheit dioktaedrische Mineralien.
Z.B. Sudoit.
- Bei Besetzung von drei Lücken/Formeleinheit trioktaedrische Mineralien
Z.B. Chlorit
(B+M,
M,
B)